O cancro do colo do útero (CCU) é, seguramente, a neoplasia maligna genital feminina mais mediática. Ao contrário do carcinoma do endométrio, é possível um rastreio populacional. Em Portugal, a doença afecta cerca de 1000 mulheres por ano e é responsável por cerca de 350 mortes. A infecção pelo vírus do papiloma humano (HPV) é uma condição necessária, embora não suficiente para o surgimento do CCU.
Este cancro apenas dá sintomas tardiamente e a queixa mais comum é a hemorragia genital anormal, como por exemplo após as relações sexuais. O rastreio consiste na realização seriada de citologias do colo do útero após o início da vida sexual. A periodicidade desse teste é um tema controverso e deverá ser discutido com o seu Ginecologista.
O diagnóstico de CCU é habitualmente efectuado por biópsia ou conização no decurso de uma colposcopia. Aliás, numa fase muito inicial a conização proporciona também o tratamento da doença. Após o diagnóstico são realizados outros exames para avaliar a extensão da neoplasia e a condição física geral da paciente.
O estádio 0 corresponde ao CIN3; no estádio I o cancro está limitado ao colo e pode ser microscópico (IA) ou clinicamente visível (IB); no estádio II a neoplasia está para além do útero, mas não invade a parede pélvica ou o 1/3 superior da vagina; no estádio III o CCU atinge essas estruturas ou causa bloqueio à drenagem renal; no estádio IV o carcinoma envolve outros órgãos da cavidade pélvica ou à distância.
Nas doentes com estádios menos avançados e candidatas a cirurgia efectua-se uma histerectomia radical (remoção do útero, tecidos de suporte e porção superior da vagina) e excisão de gânglios linfáticos. Cumprindo critérios rigorosos e em doentes seleccionadas é possível preservar a fertilidade através de uma cirurgia designada de traquelectomia radical. A radioterapia externa, a braquiterapia, a quimioterapia e os cuidados paliativos são outras modalidades terapêuticas a equacionar em função das características da neoplasia e da mulher.
Actualmente encontra-se inserida no Plano Nacional de Vacinação uma vacina destinada às adolescentes antes de iniciarem a vida sexual e que protege contra os tipos 16 e 18 do HPV, responsáveis por uma elevada percentagem do CCU.
Aproveito a oportunidade para desejar a todos os leitores um feliz Natal.
terça-feira, 27 de dezembro de 2011
Cancro ginecológico III - Colo do útero
Etiquetas:
biópsia,
cirurgia,
colo,
colposcopia,
hemorragia,
HPV
Cancro ginecológico II - Endométrio
O carcinoma do endométrio (camada que reveste o interior do útero) é o cancro genital feminino mais frequente nos países desenvolvidos. Contudo, não existe um rastreio organizado eficiente. Tipicamente ocorre após a menopausa, sendo raro antes dos 40 anos (5% dos casos).
Existem três tipos de cancro endometrial (dependente de estrogénio, independente de estrogénio e hereditário). No primeiro tipo, o mais frequente, estão identificados vários factores de risco: primeira menstruação precoce, menopausa tardia, obesidade, não ter filhos, síndrome do ovário poliquístico e terapêutica com tamoxifeno para o cancro da mama.
A queixa mais frequente é a metrorragia (hemorragia com ponto de partida no útero) após a menopausa ou perdas sanguíneas com padrão anormal nos últimos anos da vida fértil. Felizmente a doença é sintomática precocemente e a maioria das doentes é diagnosticada no estádio I.
A manifestação ecográfica é, habitualmente, um espessamento endometrial. O diagnóstico definitivo é alcançado com uma biópsia endometrial, geralmente realizada no decurso de uma histeroscopia ou por curetagem (raspagem) uterina. As doentes realizam então outros exames para avaliar a sua condição física e perceber a extensão da neoplasia.
O estadiamento definitivo é cirúrgico. No estádio I o cancro está confinado ao útero, no II atinge o colo, no III afecta a vagina, ovários ou gânglios linfáticos e no IV atinge órgãos à distância ou o interior do recto e da bexiga. No estádio I a intervenção consiste na histerectomia (remoção do útero), anexectomia (remoção dos ovários e trompas) e, quando necessário, excisão dos gânglios linfáticos pélvicos e junto à aorta. Em função do estádio e do grau (escala de 1 a 3 que expressa a desorganização celular) da neoplasia as doentes podem necessitar de cirurgias mais complexas, radioterapia externa, braquiterapia (radioterapia intravaginal), quimioterapia ou cuidados paliativos.
(Imagem: http://www.nlm.nih.gov/medlineplus/ency/imagepages/9294.htm)
Etiquetas:
biópsia,
cancro,
cirurgia,
ecografia,
endométrio,
hemorragia,
histeroscopia
terça-feira, 6 de dezembro de 2011
Cancro ginecológico I - Introdução
As doenças oncológicas são uma importante causa de mortalidade e perda da qualidade de vida. Em ambos os géneros as neoplasias malignas ocupam o segundo lugar das causas de morte nos países desenvolvidos, precedidas das doenças cardiovasculares. Os órgãos mais afectados são a próstata no homem e a mama na mulher. Tanto na mulher como no homem o cancro do pulmão é o responsável pela maioria das mortes por doença maligna.
Existem medidas preventivas capazes de reduzir a incidência de determinado cancro como por exemplo não fumar e ser cuidadoso relativamente à exposição solar. Por outro lado, há intervenções médicas capazes de detectar precocemente certos tipos de cancro ou mesmo lesões pré-cancerígenas: toque rectal e doseamento do PSA (cancro da próstata), palpação mamária e mamografia (cancro da mama), citologia do colo do útero (cancro do colo do útero). Estes procedimentos devem ter em consideração as indicações internacionalmente preconizadas, as características individuais de cada doente e o risco familiar.
Face a um diagnóstico de cancro é importante estadiar a doença, isto é, saber a sua extensão local e a disseminação para gânglios linfáticos e outros órgãos (metástases). A terapêutica das doenças oncológicas, regra geral, encontra-se bem definida em protocolos clínicos. Contudo, por vezes são necessárias adaptações em função das circunstâncias dos doentes e dos recursos disponíveis. É boa prática a tomada de decisões no âmbito de grupos multidisciplinares de forma a optimizar os resultados. De uma forma genérica, em Ginecologia, as opções de tratamento são a cirurgia, a quimioterapia, a radioterapia e a imunoterapia.
Em doentes terminais é importante a instituição de cuidados paliativos para aliviar o sofrimento e possibilitar uma morte serena.
Existem medidas preventivas capazes de reduzir a incidência de determinado cancro como por exemplo não fumar e ser cuidadoso relativamente à exposição solar. Por outro lado, há intervenções médicas capazes de detectar precocemente certos tipos de cancro ou mesmo lesões pré-cancerígenas: toque rectal e doseamento do PSA (cancro da próstata), palpação mamária e mamografia (cancro da mama), citologia do colo do útero (cancro do colo do útero). Estes procedimentos devem ter em consideração as indicações internacionalmente preconizadas, as características individuais de cada doente e o risco familiar.
Face a um diagnóstico de cancro é importante estadiar a doença, isto é, saber a sua extensão local e a disseminação para gânglios linfáticos e outros órgãos (metástases). A terapêutica das doenças oncológicas, regra geral, encontra-se bem definida em protocolos clínicos. Contudo, por vezes são necessárias adaptações em função das circunstâncias dos doentes e dos recursos disponíveis. É boa prática a tomada de decisões no âmbito de grupos multidisciplinares de forma a optimizar os resultados. De uma forma genérica, em Ginecologia, as opções de tratamento são a cirurgia, a quimioterapia, a radioterapia e a imunoterapia.
Em doentes terminais é importante a instituição de cuidados paliativos para aliviar o sofrimento e possibilitar uma morte serena.
PUPPP
A sigla que faz o título deste artigo significa “Pruritic Urticarial Papules and Plaques of Pregnancy”, doença que pode ser traduzida como pápulas e placas pruriginosas urticariformes da gravidez ou erupção polimórfica da gravidez. Trata-se de uma patologia dermatológica que afecta 0,3 a 0,8% das grávidas, particularmente as mães pela 1.ª vez e as grávidas de gémeos. O seu aparecimento é súbito e geralmente ocorre no 3.º trimestre. As lesões cutâneas são vermelhas, têm um aspecto variado (placas, pápulas, pequenas vesículas, em alvo,…), dão muita comichão, afectam inicialmente o abdómen e depois disseminam, poupando a face, as palmas das mãos e as plantas dos pés. A origem desta doença não é bem conhecida; julga-se que a distensão da pele do abdómen no final da gravidez pode desencadear uma resposta inflamatória generalizada.
Habitualmente o quadro clínico é muito exuberante e isso preocupa bastante as grávidas, levando-as a uma consulta de urgência. Felizmente esta erupção cutânea não acarreta nenhuma consequência materno-fetal, regride por completo após o parto e não tem incidência superior na gravidez subsequente. No entanto, na minha opinião, justifica-se uma consulta médica para adequada avaliação diagnóstica pois, por um lado, a comichão generalizada durante a gestação pode ter outro significado potencialmente mais grave e, por outro lado, a erupção cutânea pode representar uma doença infecciosa ou alérgica.
O tratamento desta patologia é essencialmente o alívio dos sintomas: creme hidratante em quantidade abundante, anti-histamínico oral para alívio do prurido (para além de instruções no sentido de não coçar a pele pelo risco de infectar e agravar as lesões) e, em casos mais graves, um corticóide tópico ou oral para controlar o processo inflamatório.
(Imagem: http://homebirthchoices.com/?page_id=330)
Habitualmente o quadro clínico é muito exuberante e isso preocupa bastante as grávidas, levando-as a uma consulta de urgência. Felizmente esta erupção cutânea não acarreta nenhuma consequência materno-fetal, regride por completo após o parto e não tem incidência superior na gravidez subsequente. No entanto, na minha opinião, justifica-se uma consulta médica para adequada avaliação diagnóstica pois, por um lado, a comichão generalizada durante a gestação pode ter outro significado potencialmente mais grave e, por outro lado, a erupção cutânea pode representar uma doença infecciosa ou alérgica.
O tratamento desta patologia é essencialmente o alívio dos sintomas: creme hidratante em quantidade abundante, anti-histamínico oral para alívio do prurido (para além de instruções no sentido de não coçar a pele pelo risco de infectar e agravar as lesões) e, em casos mais graves, um corticóide tópico ou oral para controlar o processo inflamatório.
(Imagem: http://homebirthchoices.com/?page_id=330)
domingo, 6 de novembro de 2011
Parto pélvico
No final de uma gravidez unifetal cerca de 2-4% dos bebés tem uma apresentação pélvica, isto é, estão sentados, tendo as nádegas, os pés ou ambos junto ao colo uterino. Existem alguns factores de risco para que isso aconteça: deformações uterinas, excesso ou escassez de líquido amniótico, mulheres que já tiveram vários filhos,… O diagnóstico pode ser efectuado através da palpação abdominal, toque vaginal, localização do foco de auscultação fetal e ecografia obstétrica.
Perante uma grávida cujo feto encontra-se pélvico há três possibilidades: programação de uma cesariana, versão cefálica externa e atitude expectante com vista ao parto pélvico por via vaginal.
A versão cefálica externa visa, através de manobras operadas sobre o abdómen da grávida, virar o bebé de modo que a cabeça fique virada para baixo. A técnica é executada por volta das 37 semanas num local com possibilidade de cesariana de emergência pelo risco de sofrimento fetal (1% dos casos). Deve haver vigilância com CTG, a bolsa de águas deve estar intacta e administra-se imunoglobulina anti-D às grávidas Rh negativas.
O parto pélvico vaginal, globalmente, acarreta maiores riscos fetais relacionados com hipóxia (falta de oxigenação adequada) e traumatismo. Assim, é importante que a grávida seja esclarecida e consinta a sua realização. Existem algumas situações em que o parto pélvico vaginal afigura-se como uma opção adequada: se a grávida chegar ao Serviço de Urgência em período expulsivo; se o 2.º gémeo estiver em apresentação pélvica; se, antecipadamente, constatar-se que o peso estimado varia entre 2000-3500g, a cabeça está flectida, as nádegas (e não os pés) estão junto ao colo uterino, a bacia parece adequada, a bolsa de águas permanece intacta até à fase activa do trabalho e parto e a equipa médica tem experiência neste tipo de parto. O nascimento deve ser espontâneo até ao umbigo, altura em que se tracciona ligeiramente o cordão umbilical; a expulsão dos membros inferiores pode ser espontânea ou ajudada; a partir da expulsão dos membros superiores, que ocorre com auxílio de determinadas manobras, faz-se pressão supra-púbica para manter a cabeça flectida; a expulsão da cabeça pode ocorrer apenas com o esforço materno, com recurso a manobras apropriadas ou com o auxílio do fórceps de Piper.
(Imagens: http://www.nlm.nih.gov/medlineplus/ency/presentations/100193_2.htm; http://baptisteast.adam.com/content.aspx?productId=14&pid=14&gid=000152; http://helid.digicollection.org/fr/d/Jwho43e/5.2.6.html#Jwho43e.5.2.6; http://www.csaol.cn/img/Hypertextbook/a/f14-2.htm)
Etiquetas:
cesariana,
Fórceps,
gravidez,
parto,
versão externa
domingo, 16 de outubro de 2011
Aborto IV - Tratamento
Na ameaça de abortamento de uma gestação inicial é limitado aquilo que pode ser proporcionado à grávida. A redução das actividades físicas, a abstinência sexual e o reforço hídrico oral são as recomendações habituais. Ainda que controversa, é possível a prescrição de progesterona. Geralmente sugere-se à grávida uma reavaliação clínica e ecográfica dentro de duas semanas ou, mais cedo, se sobrevier febre, dor pélvica intensa ou hemorragia genital muito abundante. Quando há dúvidas sobre a viabilidade da gravidez e pretende-se uma resposta em pouco tempo, pode ser doseada a hormona gonadotrofina coriónica humana (beta-HCG) no sangue da grávida com 48 horas de intervalo. O valor individual de cada determinação tem pouca importância, contudo, numa fase inicial, aumentos superiores a 67% sugerem que a gestação é evolutiva.
No abortamento em evolução é importante monitorizar os sinais vitais e as perdas sanguíneas, colocar um acesso venoso, iniciar hidratação endovenosa e administrar analgésicos para alívio da dor. Quando se associa uma anemia aguda pode ser necessária a transfusão sanguínea e, face à suspeita clínica e laboratorial de infecção, devem ser administrados antibióticos.
Perante uma mulher com aborto retido, abortamento incompleto ou gravidez anembrionada o objectivo é evacuar a cavidade uterina. Tendo em vista o futuro reprodutivo, os custos, benefícios e riscos das opções terapêuticas a indução da expulsão com fármacos precedida ou não de um período de espera afigura-se como a melhor estratégia. O controlo do tratamento é feito por ecografia pélvica. A falência da terapêutica farmacológica, a hemorragia clinicamente relevante e a infecção grave são factores que motivam a evacuação uterina cirúrgica a qual pode ser realizada por aspiração ou curetagem, geralmente sob anestesia geral.
O tratamento do abortamento recorrente está subordinado à respectiva causa: cirurgia para correcção de miomas submucosos, sinéquias e septos uterinos; ácido acetilsalicílico e/ou heparina de baixo peso molecular nas patologias que predispõem para tromboses vasculares;…
(Imagens: http://www.prolifelouisiana.org/uploads/images/Curette.jpg; http://i.pbase.com/o6/82/567982/1/75101154.caBX2gDb.syringe44671s.jpg)
No abortamento em evolução é importante monitorizar os sinais vitais e as perdas sanguíneas, colocar um acesso venoso, iniciar hidratação endovenosa e administrar analgésicos para alívio da dor. Quando se associa uma anemia aguda pode ser necessária a transfusão sanguínea e, face à suspeita clínica e laboratorial de infecção, devem ser administrados antibióticos.
Perante uma mulher com aborto retido, abortamento incompleto ou gravidez anembrionada o objectivo é evacuar a cavidade uterina. Tendo em vista o futuro reprodutivo, os custos, benefícios e riscos das opções terapêuticas a indução da expulsão com fármacos precedida ou não de um período de espera afigura-se como a melhor estratégia. O controlo do tratamento é feito por ecografia pélvica. A falência da terapêutica farmacológica, a hemorragia clinicamente relevante e a infecção grave são factores que motivam a evacuação uterina cirúrgica a qual pode ser realizada por aspiração ou curetagem, geralmente sob anestesia geral.
O tratamento do abortamento recorrente está subordinado à respectiva causa: cirurgia para correcção de miomas submucosos, sinéquias e septos uterinos; ácido acetilsalicílico e/ou heparina de baixo peso molecular nas patologias que predispõem para tromboses vasculares;…
(Imagens: http://www.prolifelouisiana.org/uploads/images/Curette.jpg; http://i.pbase.com/o6/82/567982/1/75101154.caBX2gDb.syringe44671s.jpg)
Etiquetas:
aborto,
cérvico-ístmica,
cirurgia,
ecografia,
gravidez,
incompetência,
Infecção
segunda-feira, 3 de outubro de 2011
Aborto III - Causas
O abortamento espontâneo (AE) é um fenómeno bastante frequente. Entre 25 a 30% de todas as fecundações perdem-se antes ou imediatamente após a implantação do embrião e, regra geral, passam despercebidas. Quando, na ausência de sinais ecográficos, a única evidência da gestação é um teste positivo é comum usar-se a expressão “gravidez bioquímica”. Entre 10 a 15% das mulheres com uma gravidez clinicamente identificada sofrem um AE, o qual ocorre, em 80% dos casos, nas primeiras 12 semanas de gestação.
Existem várias causas para os AE. As anomalias morfológicas do embrião e as alterações cromossómicas são uma causa frequente para a perda gestacional; assim, o abortamento pode ser encarado como um processo de selecção natural e de controlo da qualidade reprodutiva. Determinadas doenças infecciosas como a rubéola e a clamídia afectam o desenvolvimento embriofetal e aumentam o risco de AE.
Do ponto de vista materno existem diversos factores que aumentam a incidência de AE como por exemplo o lúpus, a diabetes mellitus, o consumo excessivo de tabaco, álcool e drogas e a exposição a radiações e agentes químicos como o benzeno e o chumbo. A nível uterino múltiplas condições aumentam o risco de AE: miomas submucosos, sinéquias (áreas de adesão fibrosa entre as paredes desse órgão), certas malformações como a existência de septos e a incompetência cérvico-ístmica. A incapacidade de o ovário produzir progesterona em quantidade adequada para manter a gravidez na sua fase inicial é designada de insuficiência luteínica e tem sido apontada como causa de AE. As trombofilias (deficiência de antitrombina e das proteínas C e S, mutação de Leiden do factor V, síndrome dos anticorpos antifosfolípidos,…) representam um conjunto de patologias que predispõem para tromboses vasculares e aumentam a probabilidade de AE. Há também mecanismos imunológicos envolvidos no AE, tema de elevada complexidade e ainda sob investigação científica.
(Imagens: http://www.humane-genetik.de/zytogenetik2.html; http://www.uptodate.com/contents/image?imageKey=PI/18512)
Existem várias causas para os AE. As anomalias morfológicas do embrião e as alterações cromossómicas são uma causa frequente para a perda gestacional; assim, o abortamento pode ser encarado como um processo de selecção natural e de controlo da qualidade reprodutiva. Determinadas doenças infecciosas como a rubéola e a clamídia afectam o desenvolvimento embriofetal e aumentam o risco de AE.
Do ponto de vista materno existem diversos factores que aumentam a incidência de AE como por exemplo o lúpus, a diabetes mellitus, o consumo excessivo de tabaco, álcool e drogas e a exposição a radiações e agentes químicos como o benzeno e o chumbo. A nível uterino múltiplas condições aumentam o risco de AE: miomas submucosos, sinéquias (áreas de adesão fibrosa entre as paredes desse órgão), certas malformações como a existência de septos e a incompetência cérvico-ístmica. A incapacidade de o ovário produzir progesterona em quantidade adequada para manter a gravidez na sua fase inicial é designada de insuficiência luteínica e tem sido apontada como causa de AE. As trombofilias (deficiência de antitrombina e das proteínas C e S, mutação de Leiden do factor V, síndrome dos anticorpos antifosfolípidos,…) representam um conjunto de patologias que predispõem para tromboses vasculares e aumentam a probabilidade de AE. Há também mecanismos imunológicos envolvidos no AE, tema de elevada complexidade e ainda sob investigação científica.
(Imagens: http://www.humane-genetik.de/zytogenetik2.html; http://www.uptodate.com/contents/image?imageKey=PI/18512)
Etiquetas:
1.º trimestre,
2.º trimestre,
aborto,
cérvico-ístmica,
clamídia,
ecografia,
gravidez,
incompetência,
mioma,
Rubéola
sexta-feira, 16 de setembro de 2011
Aborto II - Lei
A Lei portuguesa pune as grávidas que abortam ilegalmente com pena de prisão até 3 anos e aqueles que as fazem abortar com penas até 3 anos (se agirem com o consentimento da mulher) ou de 2 a 8 anos (se actuarem sem o consentimento da grávida). As penas são agravadas para quem pratica habitualmente o aborto ou fá-lo com intenção lucrativa ou quando do aborto resulta a morte da mulher ou ofensa à integridade física grave.
O artigo 142.º do Código Penal explicita os casos em que a interrupção da gravidez não é punível desde que efectuada por um médico, ou sob a sua direcção, em estabelecimento de saúde oficial ou oficialmente reconhecido e com o consentimento da grávida. A alínea a) salvaguarda a interrupção desde que esta constitua o único meio de remover perigo de morte ou de grave e irreversível lesão para o corpo ou para a saúde física ou psíquica da grávida. Esta alínea não se refere especificamente ao aborto. Permite, por exemplo, a indução do trabalho de parto ou a realização de uma cesariana antes do tempo por doenças graves como a pré-eclâmpsia. A alínea b) possibilita a interrupção nas primeiras 12 semanas de gestação como forma de evitar perigo de morte ou de grave e douradora lesão para o corpo ou para a saúde física ou psíquica da grávida. A alínea c) permite a interrupção quando houver seguros motivos para prever que o nascituro virá a sofrer, de forma incurável, de grave doença ou malformação congénita, e for realizada nas primeiras 24 semanas, excepcionando-se as situações de fetos inviáveis, caso em que a interrupção poderá ser praticada em qualquer altura. Ao abrigo da alínea d) pode ser executada, nas primeiras 16 semanas, a interrupção de uma gravidez que tenha resultado de um crime contra a liberdade e autodeterminação sexual. A alínea e) diz respeito à interrupção voluntária da gravidez e exclui a ilicitude do aborto quando realizado a pedido da grávida nas primeiras 10 semanas de gestação e após um período de reflexão de 3 dias.
O artigo 142.º do Código Penal explicita os casos em que a interrupção da gravidez não é punível desde que efectuada por um médico, ou sob a sua direcção, em estabelecimento de saúde oficial ou oficialmente reconhecido e com o consentimento da grávida. A alínea a) salvaguarda a interrupção desde que esta constitua o único meio de remover perigo de morte ou de grave e irreversível lesão para o corpo ou para a saúde física ou psíquica da grávida. Esta alínea não se refere especificamente ao aborto. Permite, por exemplo, a indução do trabalho de parto ou a realização de uma cesariana antes do tempo por doenças graves como a pré-eclâmpsia. A alínea b) possibilita a interrupção nas primeiras 12 semanas de gestação como forma de evitar perigo de morte ou de grave e douradora lesão para o corpo ou para a saúde física ou psíquica da grávida. A alínea c) permite a interrupção quando houver seguros motivos para prever que o nascituro virá a sofrer, de forma incurável, de grave doença ou malformação congénita, e for realizada nas primeiras 24 semanas, excepcionando-se as situações de fetos inviáveis, caso em que a interrupção poderá ser praticada em qualquer altura. Ao abrigo da alínea d) pode ser executada, nas primeiras 16 semanas, a interrupção de uma gravidez que tenha resultado de um crime contra a liberdade e autodeterminação sexual. A alínea e) diz respeito à interrupção voluntária da gravidez e exclui a ilicitude do aborto quando realizado a pedido da grávida nas primeiras 10 semanas de gestação e após um período de reflexão de 3 dias.
quinta-feira, 1 de setembro de 2011
Aborto I - Definições
O aborto tem implicações médicas, psicológicas, relacionais e religiosas. Do ponto de vista técnico “aborto” significa o produto de concepção expulso antes das 22 semanas de gravidez ou com menos de 500 gramas; “abortamento” é o processo através do qual ocorre a expulsão. Na área de Lisboa não é usual empregar-se o segundo termo. Até às 10 semanas referimos que se trata de um embrião e, a partir daí, de um feto.
Podemos classificar o aborto consoante a fase da gravidez: 1.º ou 2.º trimestre. Outra forma de designá-lo relaciona-se com a origem: espontânea, por vontade da mulher (dentro ou fora do enquadramento legal) ou medicamente induzida, por exemplo, no contexto de malformações. Independentemente da origem, quando há um processo infeccioso sobreposto denomina-se de aborto séptico. Quando uma mulher sofre três ou mais abortos consecutivos espontâneos diz-se que tem abortos de repetição.
No âmbito dos abortos espontâneos existem várias entidades.
A ameaça de aborto consiste numa gravidez evolutiva ou potencialmente evolutiva complicada por metrorragia (hemorragia oriunda do útero).
No aborto em evolução ocorre dor, metrorragia, abertura do colo útero e expulsão em curso ou iminente dos produtos de concepção.
No aborto completo, tal como o nome indica, ocorreu a expulsão da totalidade das estruturas gestacionais, o colo encontra-se fechado e, ecograficamente, não se identificam restos na cavidade uterina. Contrariamente, no aborto incompleto persistem restos ovulares (imagem superior).
Na gravidez anembrionada (imagem inferior) o saco gestacional cresce, pode até surgir uma vesícula vitelina mas o embrião não se forma; uma das definições ecográficas é a existência de um saco gestacional com mais de 20 mm de diâmetro sem embrião no seu interior.
No aborto retido há uma interrupção do desenvolvimento do embrião; uma das definições é a existência de um embrião com mais de 5 mm de comprimento sem batimentos cardíacos.
(Imagens: http://www.medicationabortion.com/mifepristone/ultrasound2.jpg; http://images.radiopaedia.org/images/145/f53480b47e02a64528a3d28fede43e.jpg)
sexta-feira, 29 de julho de 2011
Incompetência cérvico-ístmica
A incompetência, ou como prefiro designar, insuficiência cérvico-ístmica (ICI) é uma patologia que pode afectar até 1,8% das grávidas e consiste na incapacidade do útero reter a gravidez, resultando em abortos do 2.º trimestre e partos antes do tempo.
A causa da ICI não está inteiramente esclarecida; sabe-se, todavia, que os colos destas mulheres têm certas alterações bioquímicas como, por exemplo, menos elastina e mais músculo liso. Identificaram-se alguns factores de risco para a ICI: malformações uterinas, conizações, curetagens e lacerações do colo durante o parto.
A doença manifesta-se pelo apagamento e dilatação do colo na ausência de contracções dolorosas. Progressivamente, a bolsa de águas descai (IMAGEM SUPERIOR - bolsa amniótica procidente na vagina e contendo a perna do feto) e, exposta ao ambiente da vagina, rompe, levando à expulsão do feto. Com o advento da ecografia tornou-se possível monitorizar, em particular nas grávidas com antecedentes de aborto tardio e parto pré-termo, as modificações do colo uterino: afunilamento e encurtamento. Antes da gravidez não é possível, com segurança, diagnosticar a ICI.
A cerclage cervical (IMAGEM INFERIOR) consiste em abraçar e apertar o colo com um fio de sutura. Trata-se de uma cirurgia facilmente executada por via vaginal sob anestesia geral ou raquidiana. A intervenção pode ser efectuada de forma preventiva no início do 2.º trimestre em mulheres com antecedentes sugestivos de ICI. A cerclage também pode ser terapêutica quando o colo uterino apresenta alterações ecográficas típicas de ICI antes de ocorrer uma franca protusão da bolsa amniótica para a vagina.
O repouso físico e a abstinência sexual são fundamentais. Certas mulheres têm de ficar internadas várias semanas em repouso absoluto e com os membros inferiores elevados; nestas situações é necessária a prevenção de tromboses venosas e fisioterapia para minorar a atrofia muscular. Não deve ser descurado o apoio psicológico destas grávidas que, frequentemente, desenvolvem sintomas depressivos e de ansiedade.
(Imagens: http://radiographics.rsna.org/content/23/3/703/F37.large.jpg; http://studentrntiffany.files.wordpress.com/2010/05/cerclage.jpg)
A causa da ICI não está inteiramente esclarecida; sabe-se, todavia, que os colos destas mulheres têm certas alterações bioquímicas como, por exemplo, menos elastina e mais músculo liso. Identificaram-se alguns factores de risco para a ICI: malformações uterinas, conizações, curetagens e lacerações do colo durante o parto.
A doença manifesta-se pelo apagamento e dilatação do colo na ausência de contracções dolorosas. Progressivamente, a bolsa de águas descai (IMAGEM SUPERIOR - bolsa amniótica procidente na vagina e contendo a perna do feto) e, exposta ao ambiente da vagina, rompe, levando à expulsão do feto. Com o advento da ecografia tornou-se possível monitorizar, em particular nas grávidas com antecedentes de aborto tardio e parto pré-termo, as modificações do colo uterino: afunilamento e encurtamento. Antes da gravidez não é possível, com segurança, diagnosticar a ICI.
A cerclage cervical (IMAGEM INFERIOR) consiste em abraçar e apertar o colo com um fio de sutura. Trata-se de uma cirurgia facilmente executada por via vaginal sob anestesia geral ou raquidiana. A intervenção pode ser efectuada de forma preventiva no início do 2.º trimestre em mulheres com antecedentes sugestivos de ICI. A cerclage também pode ser terapêutica quando o colo uterino apresenta alterações ecográficas típicas de ICI antes de ocorrer uma franca protusão da bolsa amniótica para a vagina.
O repouso físico e a abstinência sexual são fundamentais. Certas mulheres têm de ficar internadas várias semanas em repouso absoluto e com os membros inferiores elevados; nestas situações é necessária a prevenção de tromboses venosas e fisioterapia para minorar a atrofia muscular. Não deve ser descurado o apoio psicológico destas grávidas que, frequentemente, desenvolvem sintomas depressivos e de ansiedade.
(Imagens: http://radiographics.rsna.org/content/23/3/703/F37.large.jpg; http://studentrntiffany.files.wordpress.com/2010/05/cerclage.jpg)
Etiquetas:
aborto,
cérvico-ístmica,
cirurgia,
incompetência,
pré-termo
quinta-feira, 14 de julho de 2011
LASER
LASER é um acrónimo que significa Light Amplification by Stimulated Emission of Radiation. Existem diversos tipos de LASER e são múltiplas as suas aplicações em Medicina. O âmbito deste artigo é apenas o tratamento de lesões do colo uterino, vagina e vulva.
A utilização do LASER encontra-se bastante difundida em Portugal e esta tecnologia encontra-se disponível em unidades de saúde públicas e privadas. De uma forma simplista podemos afirmar que o LASER possibilita duas vertentes terapêuticas: a destruição ou vaporização da lesão e a excisão ou remoção do tecido afectado.
Constituem exemplos de patologias passíveis de destruição por LASER: condilomas vulvares, vaginais e do colo uterino e zonas de infecção por HPV com alteração da arquitectura celular como o CIN 1 e o VaIN 1 (lesões de baixo grau do colo do útero e da vagina, respectivamente). A nível dos procedimentos excisionais destaco, por exemplo, a conização com LASER e a remoção em bloco de condilomas, quistos e VaIN2-3 (lesões vaginais de alto grau).
A utilização do LASER encontra-se bastante difundida em Portugal e esta tecnologia encontra-se disponível em unidades de saúde públicas e privadas. De uma forma simplista podemos afirmar que o LASER possibilita duas vertentes terapêuticas: a destruição ou vaporização da lesão e a excisão ou remoção do tecido afectado.
Constituem exemplos de patologias passíveis de destruição por LASER: condilomas vulvares, vaginais e do colo uterino e zonas de infecção por HPV com alteração da arquitectura celular como o CIN 1 e o VaIN 1 (lesões de baixo grau do colo do útero e da vagina, respectivamente). A nível dos procedimentos excisionais destaco, por exemplo, a conização com LASER e a remoção em bloco de condilomas, quistos e VaIN2-3 (lesões vaginais de alto grau).
Durante um tratamento ao nível do tracto genital inferior com recurso a LASER a mulher deita-se na marquesa ginecológica, é colocado um espéculo na vagina acoplado a um aspirador de fumos (excepto quando se pretende tratar lesões externas). Certos procedimentos podem ser realizados, em segurança, sem anestesia local como a destruição de CIN 1. Porém, em muitos casos é injectado um anestésico local (por vezes este fármaco tem adicionada uma substância que reduz a hemorragia e, nesses casos, é normal sentir, transitoriamente, palpitações e tremores). Durante o procedimento o médico manobra delicadamente o LASER e recorre ao colposcópio para melhor visualizar a lesão. É importante concentrar-se para não realizar movimentos bruscos quando o feixe de luz está activo pois o LASER pode acertar em zonas sensíveis não anestesiadas e provocar dor intensa e queimadura.
Após o tratamento é marcada uma consulta para reavaliação clínica; deve cumprir o período de abstinência sexual que lhe for recomendado; podem ser prescritos analgésicos ou produtos de aplicação local.(Imagem: http://www.lifelinemed.net/specialties/gynecology/)
Etiquetas:
citologia,
colo,
colposcopia,
conização,
Infecção
terça-feira, 28 de junho de 2011
HPV
O HPV (vírus do papiloma humano) tem a capacidade de infectar a pele e as mucosas e apresenta vários subtipos designados por um número. As doenças provocadas pelo vírus podem ser benignas (verrugas genitais ou noutros locais do corpo e lesões nas vias respiratórias) ou malignas (cancro do colo do útero, vagina, vulva, ânus, pénis, boca e garganta). É possível agrupar os vírus que infectam a região anogenital em função do risco de provocarem cancro: alto risco ou oncogénicos (subtipos 16, 18, 31, 33 e 45, por exemplo), baixo risco (6 e 11, por exemplo) e risco intermédio.
A indução de uma neoplasia pelo HPV é explicada pelo facto de o vírus possuir genes que, após a infecção de determinado indivíduo, começam a ser transcritos; dessa transcrição resultam proteínas que vão inibir a morte controlada e normal das células (apoptose) e estimular as células atingidas a se multiplicarem desenfreadamente.
A actividade sexual é a via de transmissão mais frequente e, por sua vez, o HPV é a infecção sexualmente transmissível mais frequente. O preservativo não é totalmente eficaz na prevenção do contágio e a transmissão do HPV não implica um acto sexual com penetração. A transmissão materno-fetal, o contacto directo não sexual e a partilha de objectos como toalhas de banho constituem formas raras de propagação viral.
Quase todas as pessoas, ao longo da sua vida, contactam com pelo menos um subtipo do HPV. Em condições normais o sistema imunitário é capaz de eliminar o vírus. Quando as células de defesa são incapazes de debelar a infecção desenvolvem-se lesões que são facilmente identificadas pelos doentes como as verrugas genitais ou outras que permanecem assintomáticas durante muito tempo como as doenças do colo do útero.
O diagnóstico assenta na observação médica e em exames complementares de diagnóstico. A citologia do colo do útero é o único rastreio universal preconizado. O tratamento não é fácil pois não existe um medicamento que elimine o vírus. De um modo geral, a terapêutica incide sobre as lesões existentes, daí a importância da sua identificação precoce.
(Imagens: http://www.google.pt/imgres?imgurl=http://www.corposaun.com/wp-content/uploads/2010/11/HPV-c%C3%A2ncer.jpg&imgrefurl=http://www.corposaun.com/virus-hpv-pode-causar-danos-em-boca-e-garganta/12070/&usg=__6jpajtKgk6VUzjABi9PQR5TUoes=&h=296&w=325&sz=154&hl=pt-PT&start=0&zoom=1&tbnid=yNUNQtOQPFYrUM:&tbnh=117&tbnw=128&ei=X6IJToGwCYOk8QOOv9ho&prev=/search%3Fq%3Dhpv%26um%3D1%26hl%3Dpt-PT%26safe%3Doff%26sa%3DN%26biw%3D1280%26bih%3D568%26tbm%3Disch&um=1&itbs=1&iact=rc&dur=94&page=1&ndsp=22&ved=1t:429,r:5,s:0&tx=126&ty=68; http://www.healthwatchcenter.com/wp-content/uploads/2007/09/hpv.jpg)
A indução de uma neoplasia pelo HPV é explicada pelo facto de o vírus possuir genes que, após a infecção de determinado indivíduo, começam a ser transcritos; dessa transcrição resultam proteínas que vão inibir a morte controlada e normal das células (apoptose) e estimular as células atingidas a se multiplicarem desenfreadamente.
A actividade sexual é a via de transmissão mais frequente e, por sua vez, o HPV é a infecção sexualmente transmissível mais frequente. O preservativo não é totalmente eficaz na prevenção do contágio e a transmissão do HPV não implica um acto sexual com penetração. A transmissão materno-fetal, o contacto directo não sexual e a partilha de objectos como toalhas de banho constituem formas raras de propagação viral.
Quase todas as pessoas, ao longo da sua vida, contactam com pelo menos um subtipo do HPV. Em condições normais o sistema imunitário é capaz de eliminar o vírus. Quando as células de defesa são incapazes de debelar a infecção desenvolvem-se lesões que são facilmente identificadas pelos doentes como as verrugas genitais ou outras que permanecem assintomáticas durante muito tempo como as doenças do colo do útero.
O diagnóstico assenta na observação médica e em exames complementares de diagnóstico. A citologia do colo do útero é o único rastreio universal preconizado. O tratamento não é fácil pois não existe um medicamento que elimine o vírus. De um modo geral, a terapêutica incide sobre as lesões existentes, daí a importância da sua identificação precoce.
(Imagens: http://www.google.pt/imgres?imgurl=http://www.corposaun.com/wp-content/uploads/2010/11/HPV-c%C3%A2ncer.jpg&imgrefurl=http://www.corposaun.com/virus-hpv-pode-causar-danos-em-boca-e-garganta/12070/&usg=__6jpajtKgk6VUzjABi9PQR5TUoes=&h=296&w=325&sz=154&hl=pt-PT&start=0&zoom=1&tbnid=yNUNQtOQPFYrUM:&tbnh=117&tbnw=128&ei=X6IJToGwCYOk8QOOv9ho&prev=/search%3Fq%3Dhpv%26um%3D1%26hl%3Dpt-PT%26safe%3Doff%26sa%3DN%26biw%3D1280%26bih%3D568%26tbm%3Disch&um=1&itbs=1&iact=rc&dur=94&page=1&ndsp=22&ved=1t:429,r:5,s:0&tx=126&ty=68; http://www.healthwatchcenter.com/wp-content/uploads/2007/09/hpv.jpg)
Etiquetas:
citologia,
colo,
colposcopia,
conização,
criocoagulação,
HPV,
Infecção,
rastreio,
útero
quarta-feira, 15 de junho de 2011
Maturação pulmonar
A idade gestacional (IG) normal para o parto está compreendida entre as 37 e as 42 semanas e 0 dias. No entanto, por vezes os bebés nascem antes do tempo (5-10%) e são designados de prematuros. A sua evolução clínica e a sua futura qualidade de vida dependem de vários factores como a IG, o peso e o motivo que condicionou o parto antecipado.
Uma das intervenções obstétricas que se revestiu de enorme sucesso na melhoria do prognóstico destas crianças consiste na estimulação da maturação pulmonar fetal. A ideia subjacente é acelerar o amadurecimento dos pulmões, reduzindo as complicações neonatais (dificuldade respiratória, hemorragia cerebral, enterocolite necrotizante e morte). Esse propósito é alcançado medicando as grávidas com betametasona, um fármaco que pertence à família dos corticóides. Advoga-se que a medicação seja dada quando existe uma elevada probabilidade de o parto ocorrer antes do tempo (rotura da bolsa amniótica, ameaça de parto pré-termo e certas patologias materno-fetais como a pré-eclâmpsia e a restrição do crescimento fetal) e quando a grávida apresenta uma IG entre as 24 semanas e as 34 semanas e 6 dias. Certas situações requerem uma abordagem individualizada como, por exemplo, o feto polimalformado em que é admissível não intervir.
A administração é feita por via intramuscular e implica duas doses de 12 mg com um intervalo de 24 horas. Embora o efeito máximo seja verificado após a 2.ª toma, existe algum benefício quando o bebé nasce menos de 24 horas após a 1.ª dose. Apesar de ser um tema controverso, a repetição de ciclos de corticóides não é defendida pela maioria dos protocolos. Existem poucas contra-indicações como, por exemplo, infecção materna muito grave. Uma das complicações frequentes é o descontrolo metabólico das grávidas diabéticas.
Quando estiver numa situação em que é provável o parto ocorrer entre as 24 e as 34 semanas e 6 dias, discuta com o seu médico a estimulação da maturação pulmonar e se é possível aguardar pelo seu benefício máximo (após a 2.ª dose).
(Imagem: http://www.lungcarecenter.com/images/lungs.gif)
Uma das intervenções obstétricas que se revestiu de enorme sucesso na melhoria do prognóstico destas crianças consiste na estimulação da maturação pulmonar fetal. A ideia subjacente é acelerar o amadurecimento dos pulmões, reduzindo as complicações neonatais (dificuldade respiratória, hemorragia cerebral, enterocolite necrotizante e morte). Esse propósito é alcançado medicando as grávidas com betametasona, um fármaco que pertence à família dos corticóides. Advoga-se que a medicação seja dada quando existe uma elevada probabilidade de o parto ocorrer antes do tempo (rotura da bolsa amniótica, ameaça de parto pré-termo e certas patologias materno-fetais como a pré-eclâmpsia e a restrição do crescimento fetal) e quando a grávida apresenta uma IG entre as 24 semanas e as 34 semanas e 6 dias. Certas situações requerem uma abordagem individualizada como, por exemplo, o feto polimalformado em que é admissível não intervir.
A administração é feita por via intramuscular e implica duas doses de 12 mg com um intervalo de 24 horas. Embora o efeito máximo seja verificado após a 2.ª toma, existe algum benefício quando o bebé nasce menos de 24 horas após a 1.ª dose. Apesar de ser um tema controverso, a repetição de ciclos de corticóides não é defendida pela maioria dos protocolos. Existem poucas contra-indicações como, por exemplo, infecção materna muito grave. Uma das complicações frequentes é o descontrolo metabólico das grávidas diabéticas.
Quando estiver numa situação em que é provável o parto ocorrer entre as 24 e as 34 semanas e 6 dias, discuta com o seu médico a estimulação da maturação pulmonar e se é possível aguardar pelo seu benefício máximo (após a 2.ª dose).
(Imagem: http://www.lungcarecenter.com/images/lungs.gif)
Etiquetas:
2.º trimestre,
3.º trimestre,
bolsa amniótica,
gravidez,
parto,
pré-eclâmpsia,
pré-termo
quinta-feira, 9 de junho de 2011
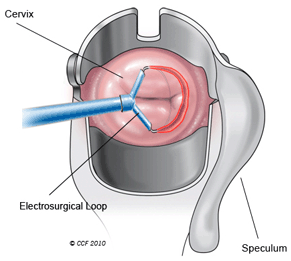
Conização
A conização é um procedimento cirúrgico realizado com bisturi, LASER ou ansa diatérmica que possibilita a terapêutica de lesões do colo do útero. Independentemente da técnica, o objectivo é remover uma fatia de colo uterino, englobando a lesão que se pretende excisar. A conização está indicada, por exemplo, nas lesões displásicas graves do colo (CIN 2 e 3) e nas lesões de baixo grau (CIN 1) muito extensas ou que se prolongam para o canal cervical.
Descreve-se a conização com recurso a ansa diatérmica. A doente posiciona-se na marquesa ginecológica e o médico introduz um espéculo metálico acoplado a um extractor de fumos. Após a observação do colo com o colposcópio é seleccionada a ansa a utilizar: trata-se de um filamento metálico em forma de semi-elipse ou semi-circunferência fixo a um manípulo, por sua vez ligado a uma fonte de energia eléctrica. Administra-se um anestésico local no colo do útero: é natural ocorrer uma sensação de picada e um desconforto caracterizado por palpitações e tremores. Em seguida o médico liga o extractor de fumos e activa a ansa no modo “corte”, passando-a na zona de colo a remover. É importante que, nesta fase, a doente fique imóvel. Recolhe-se, também, uma amostra de células do canal cervical com escovilhão ou cureta e todo o material é enviado para exame histológico. A ansa é retirada do manípulo, sendo substituída por um dispositivo que permite estancar a hemorragia através da energia eléctrica. No final do procedimento confirma-se que não existem zonas de sangramento e o material é removido. Nas quatro semanas após a conização a mulher não deve introduzir tampões, tomar banho de imersão, frequentar piscinas ou ter relações sexuais. Neste período é normal haver um corrimento mais abundante.
As complicações são pouco frequentes e incluem hemorragia, infecção e traumatismo da bexiga e da vagina por toque acidental da ansa activada. A conização torna o colo mais curto e há maior risco de abortamento do 2.º trimestre e parto pré-termo.
(Imagem: http://my.clevelandclinic.org/PublishingImages/HIC/hic-leep-procedure.gif)
Descreve-se a conização com recurso a ansa diatérmica. A doente posiciona-se na marquesa ginecológica e o médico introduz um espéculo metálico acoplado a um extractor de fumos. Após a observação do colo com o colposcópio é seleccionada a ansa a utilizar: trata-se de um filamento metálico em forma de semi-elipse ou semi-circunferência fixo a um manípulo, por sua vez ligado a uma fonte de energia eléctrica. Administra-se um anestésico local no colo do útero: é natural ocorrer uma sensação de picada e um desconforto caracterizado por palpitações e tremores. Em seguida o médico liga o extractor de fumos e activa a ansa no modo “corte”, passando-a na zona de colo a remover. É importante que, nesta fase, a doente fique imóvel. Recolhe-se, também, uma amostra de células do canal cervical com escovilhão ou cureta e todo o material é enviado para exame histológico. A ansa é retirada do manípulo, sendo substituída por um dispositivo que permite estancar a hemorragia através da energia eléctrica. No final do procedimento confirma-se que não existem zonas de sangramento e o material é removido. Nas quatro semanas após a conização a mulher não deve introduzir tampões, tomar banho de imersão, frequentar piscinas ou ter relações sexuais. Neste período é normal haver um corrimento mais abundante.
As complicações são pouco frequentes e incluem hemorragia, infecção e traumatismo da bexiga e da vagina por toque acidental da ansa activada. A conização torna o colo mais curto e há maior risco de abortamento do 2.º trimestre e parto pré-termo.
(Imagem: http://my.clevelandclinic.org/PublishingImages/HIC/hic-leep-procedure.gif)
Etiquetas:
citologia,
colo,
colposcopia,
conização
segunda-feira, 9 de maio de 2011
Aloimunização Rh D

O grupo de sangue é definido por proteínas que existem à superfície dos glóbulos vermelhos. Assim, há os grupos AB, A, B e 0 (zero) e quando a eles nos referimos também dizemos se são “positivos” ou “negativos”. Isso deve-se, respectivamente, à presença (85% dos casos) ou ausência (15%) do factor D do sistema Rh. Para além desse sistema existem outros como Kell, MNS e Duffy.
Na aloimunização Rh D (IMAGEM DE CIMA), anticorpos da mãe (Rh D-) atravessam a placenta, reconhecem e destroem os glóbulos do feto que possuem factor D (Rh D+), provocando a doença hemolítica perinatal (DHP). Para que este fenómeno ocorra é necessário que, no passado daquela mulher, o sistema imunitário tenha contactado com células Rh D+ (gravidez anterior, toxicodependência com partilha de seringas e transfusões). Na DHP verifica-se anemia no bebé, a qual pode levar à hidrópsia (inchaço generalizado e derrames em serosas como o peritoneu, a pleura e o pericárdio), a lesões orgânicas irreversíveis e à morte (intra-uterina ou após o nascimento).
É fundamental a prevenção desse tipo de contactos, assumindo um papel de destaque a administração de imunoglobulina (Ig) anti-D em situações específicas: aborto ou ameaça de aborto, gravidez ectópica, mola hidatiforme, após uma técnica obstétrica invasiva como a amniocentese ou a biópsia das vilosidades coriónicas, após traumatismo abdominal na 2.ª metade da gravidez, após versão cefálica externa, às 28 semanas de gestação quando o teste de Coombs indirecto é negativo e após o parto de um recém-nascido Rh D+. A introdução da Ig anti-D na prática clínica reduziu a taxa de aloimunização Rh D de 16% para 0,2%. Trata-se de um fármaco injectável e deve ser administrado precocemente, de preferência nas primeiras 72 horas após o evento. Em situações recorrentes, não é necessário fazer nova administração se a anterior tiver ocorrido há menos de 3 semanas.
Apesar da implementação de medidas preventivas da aloimunização Rh D, continua a ser importante a vigilância adequada das grávidas Rh negativas. Estas mulheres realizam periodicamente o teste de Coombs indirecto (IMAGEM CENTRAL). Trata-se de uma análise sanguínea em que são pesquisados anticorpos maternos capazes de reconhecer e destruir glóbulos vermelhos Rh D+. Quando os resultados são negativos, a grávida pode ser tranquilizada; propõe-se a administração de imunoglobulina anti-D às 28 semanas de gestação somente se o teste realizado cerca de duas semanas antes for negativo. Esta dose previne que o sistema imunitário da mãe fique sensibilizado durante eventuais trocas sanguíneas com o feto no final da gestação. A partir deste momento a análise não deve ser repetida.
Quando o teste é positivo há que saber o respectivo valor (ou título), expresso sob a forma de uma fracção matemática (1/2, 1/4,…). Considera-se crítico quando o denominador é igual ou superior a 16. Nestes casos é feita uma avaliação ecográfica seriada para determinar se existe evidência de anemia no bebé. Um dos parâmetros analisados é a velocidade do sangue na artéria cerebral média (IMAGEM DE BAIXO). Quando os valores são normais a gravidez evolui até por volta das 38-39 semanas, altura em que se provoca o parto se não houver contra-indicação para a via vaginal. Se os valores estiverem alterados (fluxo demasiado rápido), pode ser executada uma cordocentese (colheita de sangue do cordão umbilical) e, caso se confirme a anemia, procede-se a uma transfusão intra-uterina ou ao parto.
A opção pela vigilância por amniocenteses seriadas, apesar dos riscos e da menor sensibilidade e especificidade, continua a ser válida em casos seleccionados e possibilita verificar ad initio se o grupo sanguíneo fetal é, realmente, Rh D+.
Devido à complexidade destes casos, é fundamental o empenho de toda a equipa médica e o esclarecimento do casal acerca das opções diagnósticas e terapêuticas.
(Imagens: http://www.google.pt/imgres?imgurl=http://lh5.ggpht.com/_lo6dMUWpLMA/S06u7Z6FTnI/AAAAAAAAAOE/K5INBYlYuII/Hemolytic%2520Disease%2520of%2520the%2520Fetus%2520and%2520Newborn.jpg&imgrefurl=http://www.lookfordiagnosis.com/images.php%3Fterm%3DRh%2BIsoimmunization%26lang%3D1%26from%3D56&usg=__8GTiaGkgRrG97nvRXw67J3kfCpE=&h=320&w=400&sz=33&hl=pt-PT&start=23&zoom=1&tbnid=5mLAoJedrZodxM:&tbnh=119&tbnw=149&ei=xvnHTcjYNIuwhAeHna38Aw&prev=/search%3Fq%3Disoimmunization%26um%3D1%26hl%3Dpt-PT%26biw%3D1345%26bih%3D564%26tbm%3Disch0%2C592&um=1&itbs=1&iact=hc&vpx=843&vpy=213&dur=0&hovh=201&hovw=251&tx=157&ty=120&page=2&ndsp=23&ved=1t:429,r:20,s:23&biw=1345&bih=564; http://www.womenshealthsection.com/content/art_images/obsdu008a.jpg; http://www.merckmanuals.com/media/professional/figures/Figure2sec11ch131_eps.gif)
Etiquetas:
aloimunização,
amniocentese,
boletim,
coombs,
cordocentese,
ecografia,
gravidez,
hidrópsia,
imunoglobulina,
Rh
terça-feira, 3 de maio de 2011
Criocoagulação


A criocoagulação é um tratamento baseado no poder destrutivo de uma fonte de frio intenso. Esta tecnologia é fácil, rápida, barata e pode ser utilizada em certas lesões do colo uterino como o ectropion (exposição das células do interior do colo, acompanhada de corrimento, hemorragia e dor durante as relações sexuais) e CIN 1 (lesão de baixo grau provocada pelo vírus HPV). A criocoagulação, enquanto método destrutivo, não deve ser utilizada em lesões que se prolonguem para o interior do colo, extensas ou de alto grau (CIN 3).
Antes de efectuar este tipo de intervenção, o Ginecologista toma em consideração as queixas e expectativas da doente, os resultados da citologia e eventualmente das biópsias efectuadas e os achados da colposcopia. É importante que a doente compreenda a opção por este tratamento, quais as suas potencialidades e limitações.
Se estiverem reunidos os critérios para se efectuar esta terapêutica é programada a data, preferencialmente na semana após o fim da menstruação. A doente não precisa estar em jejum e coloca-se na marquesa ginecológica. Não é necessária anestesia. O médico introduz o espéculo e aproxima uma sonda metálica ao colo; essa sonda está acoplada a uma botija de gás (dióxido de carbono ou óxido nitroso) e, quando activada, arrefece de imediato; a transmissão do frio vai congelar a zona que fica em contacto com a sonda. Nesta altura é normal sentir desconforto semelhante a uma cólica menstrual (se persistir poderá tomar um analgésico). Um esquema de criocoagulação consiste em duas sequências de 3’ com um intervalo de 5’. Nas 3 semanas após o procedimento não deve ter relações sexuais, introduzir tampões, frequentar piscinas ou tomar banho de imersão. É normal ter um corrimento aquoso e abundante (descamação da zona do colo que foi destruída). O seu Ginecologista indicará a data da consulta subsequente para reavaliar o colo e determinar se o tratamento foi eficaz.
Etiquetas:
citologia,
colo,
colposcopia,
criocoagulação
terça-feira, 12 de abril de 2011
Amenorreia

Amenorreia, literalmente, significa ausência de menstruação. Pode ser primária se a mulher nunca teve período menstrual ou secundária quando cessam os ciclos menstruais numa mulher que anteriormente os tinha (normais ou irregulares).
A amenorreia primária é diagnosticada a partir dos 13 anos nas jovens que não menstruam nem apresentam caracteres sexuais secundários como por exemplo desenvolvimento mamário. Quando existem essas características, o diagnóstico só é feito aos 15 anos.
O intervalo de tempo necessário para se definir a amenorreia secundária não é consensual, sendo apontados 3 a 6 meses de ausência de período. Realça-se que ciclos menstruais superiores a 35 dias são anormais (oligomenorreia), frequentemente associados a problemas de ovulação.
A avaliação médica é feita por etapas e envolve uma entrevista clínica, exame físico geral e ginecológico, análises laboratoriais, ecografia ginecológica e provas com progestativo e estroprogestativo (testes com medicamentos para se averiguar se provocam a menstruação). Em casos específicos são pedidos outros meios complementares de diagnóstico como estudos genéticos, ressonância magnética e histeroscopia. Por vezes é necessário acompanhamento noutras áreas como a Endocrinologia, Psicologia, Genética, Neurocirurgia, Medicina da Reprodução,…
Existem inúmeras causas para a amenorreia: gravidez, anomalias congénitas do útero e da vagina, alterações da tiróide, aderências nas paredes uterinas após uma curetagem, falência dos ovários após o tratamentos de um cancro ou devido a uma anomalia genética, tumores da hipófise produtores de prolactina, síndrome do ovário poliquístico, exercício físico excessivo, anorexia nervosa,…
Se tem ciclos menstruais superiores a 35 dias, se está há mais de 3 meses sem menstruar, se tem 13 anos e nunca menstruou, sugiro que marque uma consulta de Ginecologia para obter uma adequada orientação clínica.
(Imagem: http://www.soc.ucsb.edu/sexinfo/images/05-07-Menstrual.jpghttp://www.soc.ucsb.edu/sexinfo/images/05-07-Menstrual.jpg)
terça-feira, 22 de março de 2011
Infertilidade VII - Azoospermia

A azoospermia consiste na ausência de espermatozóides no ejaculado. Este diagnóstico afecta cerca de 1% de todos os homens e 10-15% dos homens inférteis. Pode ser devida a diversas causas: falência do sistema hormonal do hipotálamo e da hipófise; incapacidade intrínseca do testículo de executar por completo a espermatogénese (produção de espermatozóides); e impossibilidade de os espermatozóides efectuarem o seu trajecto desde os testículos até ao pénis devido, por exemplo, a vasectomia anterior ou obliteração do epididimo.
Os homens com azoospermia são detalhadamente avaliados, incluindo entrevista clínica, exame físico, cariótipo (análise dos cromossomas), estudo molecular do cromossoma Y e determinações hormonais. A alteração do cariótipo mais frequente é a síndrome de Klinefelter (47, XXY).
Nalgumas situações estão indicados tratamentos hormonais para repor as hormonas em falta (hipogonadismo hipogonadotrófico) como na síndrome de Kallmann, doença que, para além da infertilidade, cursa com ausência de olfacto, testículos e pénis pequenos e pilosidade escassa.
No âmbito da Medicina da Reprodução, a biópsia testicular (BT), em casos seleccionados, permite obter espermatozóides que são criopreservados e posteriormente usados numa ICSI (Saúde da Mulher, 24/02/2011). Ainda se encontra em fase de apuramento técnico-científico a maturação laboratorial de células precursoras dos espermatozóides.
A BT pode ser realizada com uma agulha ou através de uma pequena intervenção cirúrgica. Neste último caso toma o nome de TESE (testicular sperm extraction) e consiste num procedimento sob anestesia em que o escroto e a cápsula que reveste o testículo são abertos; em seguida são removidos fragmentos de testículo que, em caso de sucesso, contêm espermatozóides. As complicações são raras e incluem infecção e hemorragia. Após a BT o homem deve repousar, aplicar gelo e tomar analgésicos.
(Imagem: http://www.seremas.com/english/images/azoospermia.jpg)
Etiquetas:
azoospermia,
biópsia,
espermograma,
ICSI,
infertilidade,
testículo
domingo, 27 de fevereiro de 2011
Infertilidade VI - Inseminação artificial

A inseminação artificial (IA) é uma técnica de reprodução medicamente assistida que consiste na estimulação ovárica seguida da deposição de esperma tratado na cavidade uterina. Realiza-se em centros públicos ou privados especializados em Medicina Reprodutiva e envolve uma equipa interdisciplinar de médicos, enfermeiros e biólogos. Está indicada, por exemplo, quando o muco do colo do útero é “hostil”, na endometriose ligeira, na síndrome do ovário poliquístico, na infertilidade inexplicada, nas alterações ligeiras do espermograma ou quando o homem é portador de uma doença sexualmente transmissível como a infecção VIH/Sida (nestas situações é efectuada uma lavagem do esperma). Na ausência de produção de espermatozóides e quando aceite pelo casal, pode ser realizada, ao abrigo da legislação em vigor, IA com esperma de dador.
A mulher realiza análises hormonais e uma ecografia ginecológica entre o 2.º e o 4.º dias do ciclo. Com base nesses dados é definida a data de início, a dose e o tipo de gonadotrofina a administrar (fármaco usado para estimular o desenvolvimento dos folículos ováricos). Programa-se o dia em que a mulher irá regressar para efectuar análises e ecografia; este(s) controlo(s) pretende(m) avaliar como está a decorrer a estimulação. Quando tudo corre bem apenas 1 folículo torna-se dominante, diminuindo o risco de gravidez múltipla. Define-se o momento da administração da hormona gonadotrofina coriónica e, decorridas 36 horas, executa-se a IA. Nesse dia o homem fornece o esperma, o qual é submetido a um processamento laboratorial. A IA é feita em ambulatório, sem anestesia e assemelha-se a um exame ginecológico à excepção da introdução de um catéter de plástico através do colo pelo qual o esperma é depositado no topo da cavidade uterina. Recomenda-se ao casal ter relações sexuais na noite após a IA. Caso não menstrue, a mulher realiza um teste de gravidez 2 a 3 semanas após a IA.
(Imagem: http://www.realbollywood.com/news/up_images/artificial-insemination544.jpg)
Etiquetas:
infertilidade,
inseminação,
PMA,
RMA
Infertilidade V - FIV / ICSI

A fertilização in vitro (FIV) e a micro-injecção intracitoplasmática do espermatozóide (ICSI) são técnicas para o tratamento dos casos mais graves de infertilidade como graus avançados de endometriose e alterações profundas do espermograma.
No 2.º/3.º dia do ciclo menstrual a mulher realiza análises e ecografia pélvica e inicia as injecções de gonadotrofinas que estimularão o crescimento de vários folículos ováricos. Marcam-se sucessivas reavaliações para monitorizar o progresso laboratorial e ecográfico. Para assegurar o controlo artificial do ciclo são utilizados agonistas (iniciados por volta do 22.º dia do ciclo anterior) ou antagonistas (começados após o início das gonadotrofinas) de GnRH. Quando os folículos têm dimensões adequadas e os níveis de estradiol estão apropriados, é administrada hormona gonadotrofina coriónica com vista ao amadurecimento final dos folículos. Decorridas 36 horas recolhem-se os óvulos, sob anestesia geral, através da punção transvaginal dos ovários. Nesse dia são adicionados os espermatozóides obtidos na altura ou previamente congelados; se forem depositados sobre os óvulos, fecundando-os sem auxílio estamos perante uma FIV; se forem injectados no interior dos óvulos trata-se de uma ICSI. A decisão é, muitas vezes, tomada no momento face às características do material biológico. Os óvulos fecundados ficam numa estufa e, quando os embriões têm 4 a 8 células, são transferidos para o útero. Esta etapa não requer anestesia e assemelha-se a um exame ginecológico à excepção do delicado catéter através do qual são introduzidos 1 ou 2 embriões. Os que sobram são preservados para utilização noutro ciclo caso este fracasse. O último medicamento usado é a progesterona intravaginal que dará suporte hormonal à gravidez até ao pleno funcionamento da placenta. Duas semanas após a transferência realiza-se um teste de gravidez sanguíneo que, se for positivo, é repetido passadas 48 horas.
(Imagem: http://luv4.us/wp-content/uploads/1/9316350725.gif)
Etiquetas:
FIV,
ICSI,
infertilidade,
PMA,
RMA
quinta-feira, 27 de janeiro de 2011
Infertilidade IV – Espermograma

O espermograma é um exame básico estudo da infertilidade e consiste na análise laboratorial do esperma. A colheita é feita por masturbação, precedida de 2 a 7 dias de abstinência de ejaculações. A recolha deve incluir todo o líquido para um recipiente apropriado. É importante que o homem não se sinta embaraçado em relatar qualquer perda acidental. A obtenção do produto é feita no laboratório. Excepcionalmente, pode ser realizada no domicílio, garantindo-se o transporte em condições adequadas (entrega em menos de 1 hora e temperatura entre 20 a 37 ºC). Frequentemente é necessário repetir a análise antes de se fazer determinado diagnóstico. A espermocultura determina se há bactérias no esperma; implica urinar primeiro, lavar bem as mãos e o pénis e ejacular para um frasco esterilizado.
A análise macro e microscópica do esperma é um processo complexo e envolve inúmeros parâmetros. A Organização Mundial de Saúde publicou em 2010 um manual com linhas de orientação referentes ao espermograma. As principais características avaliadas são: volume do esperma (> 1,5 mL); concentração de espermatozóides (> 15 milhões/mL); mobilidade progressiva (> 32%); e formas normais (> 4%). Os valores de referência, colocados entre parêntesis, dizem respeito ao percentil 5 dos homens cujas mulheres engravidaram em 12 meses de relações sexuais frequentes e sem método contraceptivo. Os valores medianos da população (percentil 50) são mais elevados. Os achados patológicos são descritos com termos complexos: oligozoospermia – poucos espermatozóides; astenozoospermia – espermatozóides lentos; teratozoospermia – espermatozóides anormais; azoospermia – ausência de espermatozóides no ejaculado.
É fundamental que o homem realize esta análise num centro que cumpra os exigentes critérios laboratoriais, aconselhando-se junto da equipa médica e de enfermagem que acompanha o casal infértil.
(Imagem: http://www.drmalpani.com/images//sperm.jpg)
Infertilidade III – Histerossalpingografia

A histerossalpingografia (HSG) é um exame radiológico que assume um papel importante na Medicina da Reprodução pois permite avaliar a morfologia da cavidade uterina e se as trompas de Falópio estão permeáveis. A HSG pode ser útil noutras áreas como o estudo da morte fetal/abortos de repetição e a confirmação da obstrução tubária após colocação de dispositivo intratubário. Para além do seu valor diagnóstico, a HSG tem potencialidades terapêuticas: libertação de pequenas obstruções uterinas e das trompas; melhoria das propriedades do muco cervical e da camada de revestimento das trompas; e eliminação de algumas bactérias.
O exame é geralmente programado para a semana seguinte à menstruação. A doença inflamatória pélvica, a alergia ao contraste iodado e a gravidez são contra-indicações absolutas. A mulher não deve estar em jejum e é pré-medicada com um analgésico. Durante o procedimento a doente fica deitada de costas com as pernas afastadas e os joelhos flectidos. O médico desinfecta os genitais externos, introduz um espéculo, desinfecta a vagina, coloca uma pinça no colo do útero e introduz o cateter no orifício externo do colo. Em seguida é removido o espéculo e a doente pode estender as pernas ao longo do corpo. Durante a introdução do contraste pelo cateter, são obtidas imagens radiológicas em tempo real (fluoroscopia). Ao longo do exame o ginecologista dá indicação para a captura de imagens que poderão ser impressas numa película ou armazenadas em suporte informático. Nalguns casos pode ser solicitada a inclinação lateral do tronco. A doente deve tentar permanecer tranquila para não comprometer a qualidade das imagens. De um modo geral a HSG é desconfortável mas tolerada pela maioria das doentes. Consoante o protocolo de cada instituição a mulher poderá ser medicada com um antibiótico antes ou após o exame.
Questão: Estou a ser seguida no Hospital de Santa Maria porque não consigo engravidar (...) Fiz uma histerossalpingografia em Dezembro. Disseram-me que tinha as trompas permeáveis mas com retenção. O que significa isso? (Susana, Odivelas)
Resposta: A sua questão tem bastante pertinência. Cerca de 15 minutos após a realização da histerossalpingografia (HSG), exame descrito na última edição do Jornal de Odivelas, é usual a obtenção de uma radiografia simples em pé da cavidade pélvica. Essa película é detalhadamente observada e, entre outros aspectos, procura-se identificar meio de contraste, que é radiopaco, retido nas trompas de Falópio. A sua presença manifesta-se pela existência de uma imagem filiforme, hipotransparente que delineia o trajecto das trompas. Trata-se de um achado anómalo na medida em que uma HSG normal pressupõe a saída do líquido de contraste das trompas e respectiva constatação na radiografia simples em pé. A retenção de contraste associa-se a um risco acrescido de gravidez ectópica. Assim, tendo em conta as expectativas do casal, os antecedentes obstétricos e outros elementos da entrevista clínica, a observação médica, os resultados dos demais exames e outros dados da HSG, a equipa médica e o casal devem discutir as opções terapêuticas e a conduta a adoptar.
(Imagem: http://www.szote.u-szeged.hu/radio/emlo/emlo8c.gif - Exame normal; as setas apontam para as Trompas de Falópio)
Etiquetas:
histerossalpingografia,
infertilidade
Subscrever:
Mensagens (Atom)